提速小麥單倍體技術產業(yè)化進程——原創(chuàng)小麥單倍體花青素標記鑒別系統(tǒng)
日期:2023-03-08 17:31:35
小麥是世界上最重要的糧食作物之一,為人類提供約20%的食物熱量。隨著全球人口的增加���,2050年小麥產量需要提高70%��,培育優(yōu)良品種是提高產量的有效途徑�����。然而���,使用傳統(tǒng)方法非常耗時,培育一個新的小麥品種通常需要至少8-10年����。但通過雙單倍體(Doubled Haploid,DH)育種技術的運用����,純系只需1-2個世代即可產生�����,顯著縮短育種周期�����,大大加快了育種進程�����。DH系生產包括3個環(huán)節(jié)����,即單倍體誘導 �、單倍體加倍和DH系繁殖與鑒定,每個環(huán)節(jié)都對純系的生產效率至關重要��。
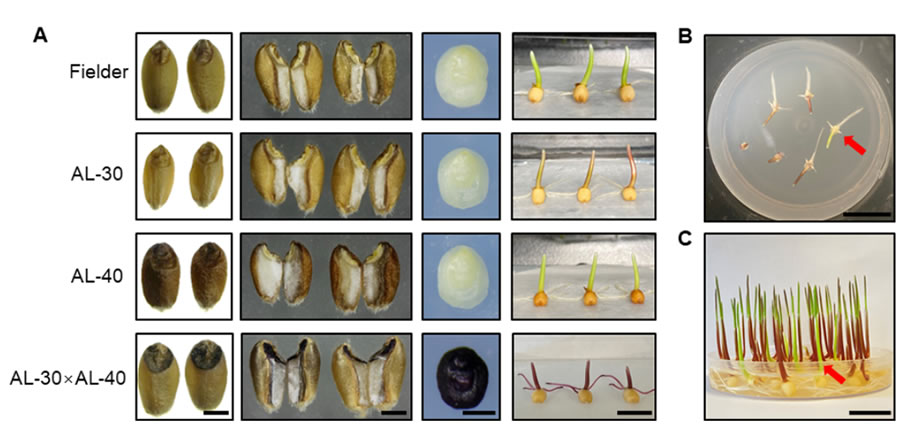
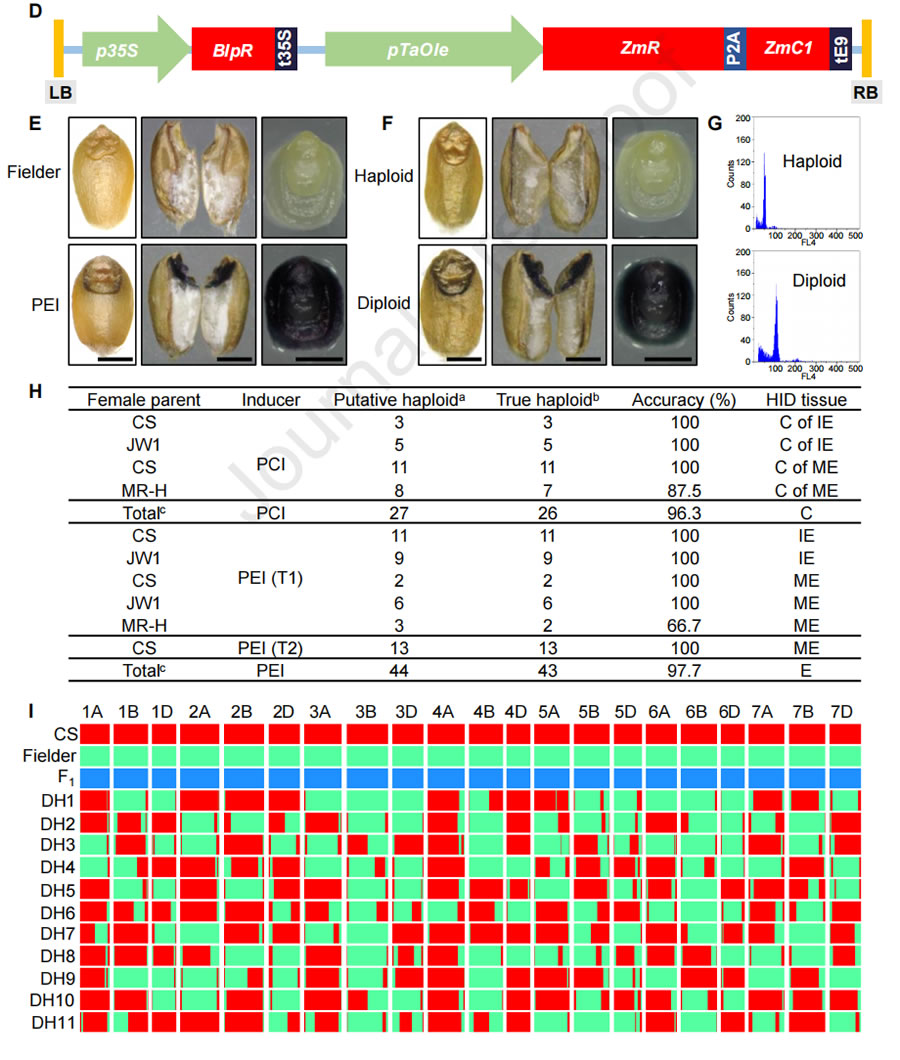
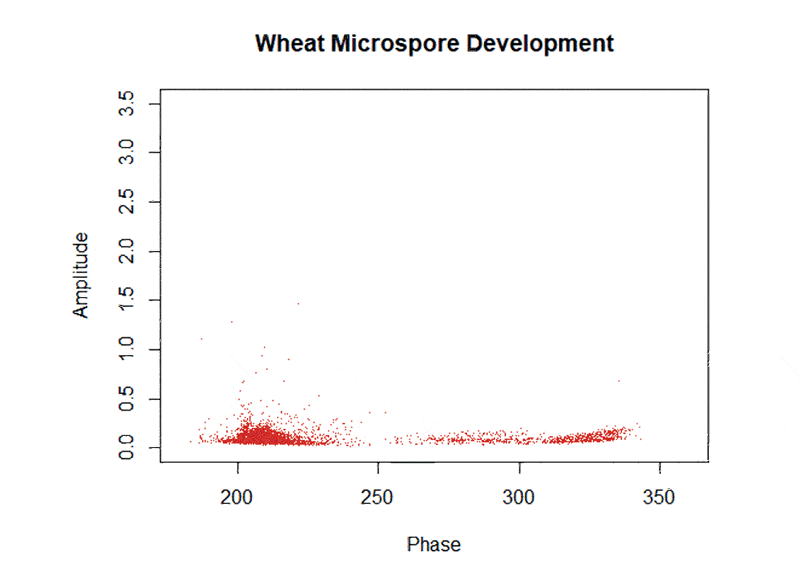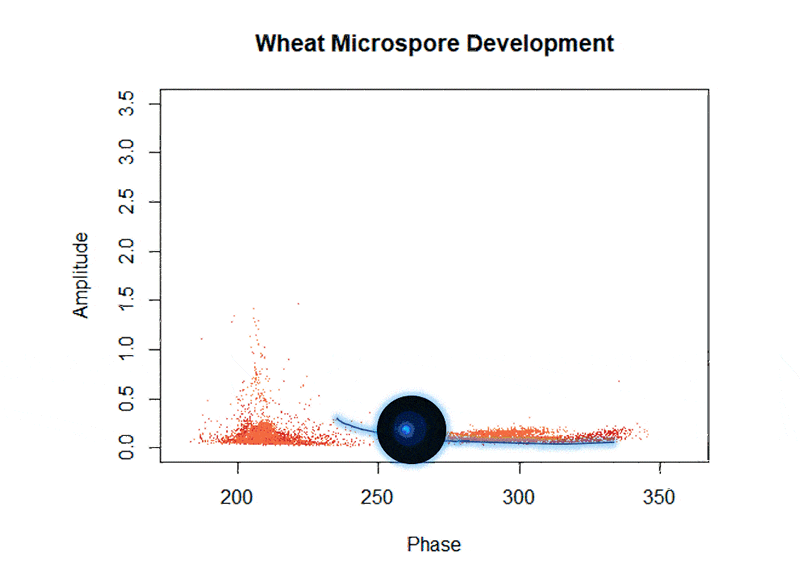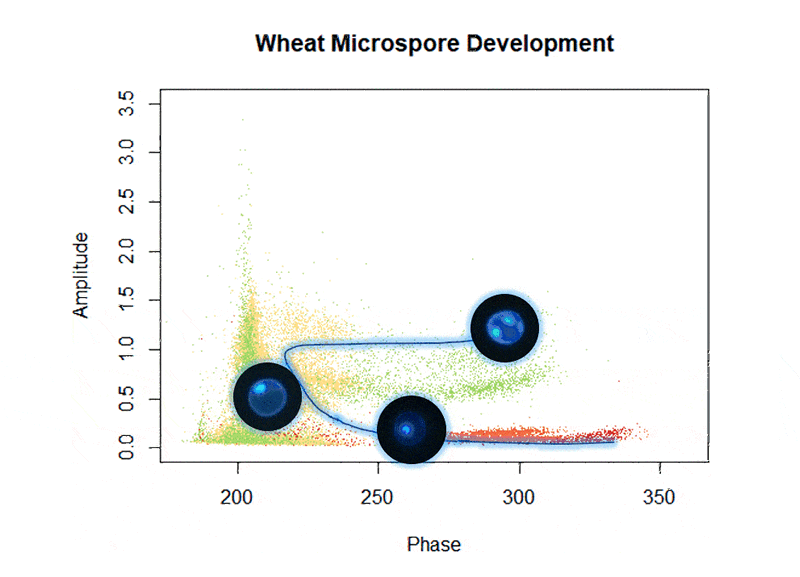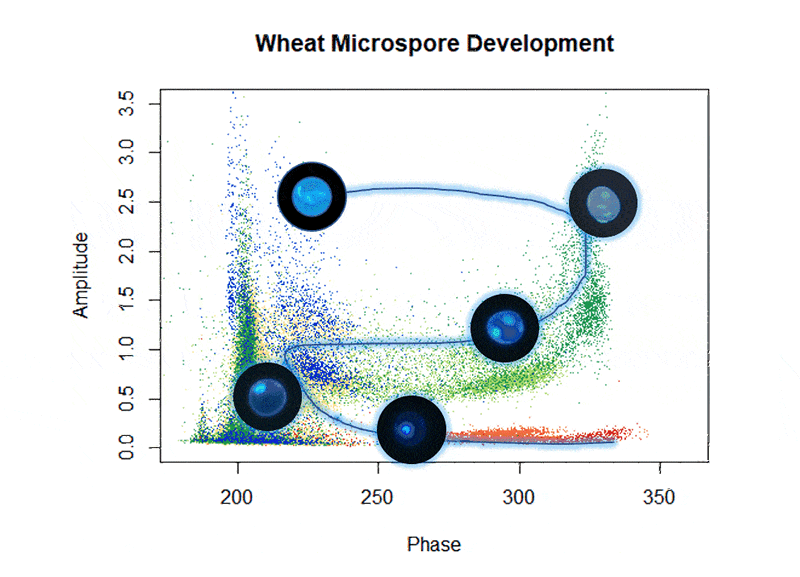
在小麥單倍體誘導環(huán)節(jié)�,前期中國農業(yè)大學團隊研究團隊通過敲除玉米單倍體誘導關鍵基因ZmPLA1的同源基因,率先在小麥中建立了單倍體誘導(haploid induction, HI) 技術體系��,單倍體誘導效率高于20%�。小麥單倍體技術體系雖有了高效的誘導技術,但是該技術的應用仍需解決小麥單倍體鑒別等問題�����,開發(fā)高效的標記是實現小麥單倍體鑒別(haploid identification, HID) 的核心。2023年3月1日����, Plant Communications在線發(fā)表了中國農業(yè)大學陳紹江、劉晨旭團隊題為“Establishment of an efficient haploid identification system by engineering anthocyanin accumulation in wheat embryo”�����,該研究利用玉米花青素調控基因ZmC1和ZmR�,成功創(chuàng)制了小麥紫胚芽鞘誘導系PCI和紫胚誘導系PEI,實現了小麥單倍體的精準鑒別��,并利用PEI誘導系成功創(chuàng)制了DH系���,展現了該技術在小麥育種中的應用前景�。前人研究表明ZmC1和ZmR可以調控植物花青素合成��,中國農業(yè)大學研究團隊為了測試使用ZmC1和ZmR進行小麥HID的可行性�,評估了轉基因品系AL-30和AL-40的色素沉著情況�����,這些品系分別含有pUbi驅動的ZmC1和pUbi驅動的ZmR。AL-30和AL-40在胚胎和種皮分別出現色素沉著(圖1A)��。除此以外���,在胚胎或胚乳中沒有發(fā)現AL-30���、AL-40和野生型之間的差異。接下來��,通過將AL-30和AL-40雜交���,研究團隊創(chuàng)造了一個同時具有ZmC1和ZmR的F1����。結果表明����,成熟的胚胎(ME),未成熟的胚胎(IE)和F1果核的外胚層都顯示出深紫色色素�����,表明ZmC1和ZmR能協同促進花青素的積累(圖1A)���。然而����,ZmC1和ZmR的同時過表達也導致導致葉片強烈的色素沉著,嚴重阻礙了幼苗的生長�,最終導致死亡。因此����,不能簡單地將pUbi驅動的ZmC1和ZmR用于小麥的HID。研究團隊將組成型表達ZmC1的材料AL-30與誘導系進行雜交�����,通過分子標記與表型輔助選擇�����,育成了紫胚芽鞘誘導系PCI����。利用該誘導系雜交的后代,根據胚芽鞘顏色可實現單倍體精準鑒別(圖1B-C)����,單倍體鑒別準確率為96.3%(圖1G-H)。圖1 中國農業(yè)大學研究團隊建立的高效小麥HID系統(tǒng)為了在種子階段實現可視化的HID���,研究團隊確定了一個胚胎偏好的啟動子Oleosin-like基因—TaOle�����。TaOle的1419bp啟動子片段與ZmR和ZmC1的CDS融合�,構成pTaOle驅動的ZmR-P2A-ZmC1表達載體(圖1D)�。將該載體被轉化到小麥單倍體誘導系TaPLA-4A和TaPLA-4D中,結果表明所有四個陽性轉基因植株在IE和ME中都顯示出深紫色的色素沉著��,但在其他組織中沒有染色�,表明pTaOle在轉基因植物的胚胎中工作良好(圖1E)。更重要的是���,這些轉基因植物的生長和發(fā)育沒有受到影響�����,這是對AL-30和AL-40的F1雜種的巨大改良�。在T1代中�,具有ZmR-P2A-Zm純合基因型的個體被篩選并命名為紫色胚胎誘導系(PEI)。為了測試HID的性能,我們用CS�����、JW1和MR-H的胚胎供體植物與花粉來自同源的T1 PEI植物的花粉雜交���。根據IE和ME中色素沉著的缺失情況�,篩選出推測的單倍體(圖1F)�,并通過流式細胞儀和表型進一步驗證(圖1G)。在IE階段��,有11個和9個推定的單倍體分別來自CS和JW1����,后被驗證為真正的單倍體;在ME階段��,有2個���、6個和3個假定的單倍體分別來自CS����、JW1和MR-H���。倍性分析的結果顯示分析結果顯示���,只有MR-H的一個推定單倍體被發(fā)現是二倍體(6N)���。為了進一步評估HID的準確性�,在T2代中篩選了13個假定的CS單倍體,所有這些都被證實是真正的單倍體�����。因此���,在IE和ME階段的總體HID準確性為97.7%(圖1H)�����。同樣的方法用于驗證18個假定的二倍體(6N)的紫色胚胎����,所有這些胚胎都被確認為真正的二倍體(6N)���。上述結果表明�����,PEI可以實現小麥的高效HID����。此外,研究團隊將F1雜交種(CS×Fielder)與PEI雜交�,產生單倍體用于染色體加倍??偣搏@得11個單倍體,所有的單倍體在秋水仙素處理后都加倍了���。為了研究DH是否在所有的染色體上都是純合的��,用靶向測序技術對11個DH的基因組進行了基因分型�����。9158個單核苷酸多態(tài)性(SNPs)的生物信息學分析顯示�,沒有一個DH攜帶雜合的位點(圖1I)���,表明PEI可以誘導純合子���,并可能成為小麥DH育種的一個前景廣闊的工具��。該研究原創(chuàng)的小麥單倍體花青素標記鑒別系統(tǒng)��,為新型小麥單倍體育種技術從理論研究到實踐應用邁出了一大步�����,提速小麥單倍體技術產業(yè)化的進程�����,對于加快小麥育種進程具有里程碑式的意義。綜上所述�, DH育種因具備周期短、純度高等優(yōu)點��,獲得了國內外各大農業(yè)公司及育種單位的密切關注��。對于種業(yè)公司來說���,早日推出優(yōu)異新品種就可以早日獲取效益�,而對于育種家們來說���,縮短育種周期��、加快育種速度是他們畢生的奮斗目標�。隨著單倍體誘導關鍵調控基因的進一步挖掘和基因編輯技術的聯合使用, DH育種技術已經不僅僅局限在玉米純系的創(chuàng)制上����,其應用也由玉米拓展到單子葉作物水稻、小麥���、谷子��,以及雙子葉擬南芥�、蒺藜苜蓿�����、番茄����、煙草等多種植物上,未來 DH育種技術在作物育種和改良上將發(fā)揮更大的作用�����,糧食作物以及蔬菜經濟作物工廠化應用將很快到來�����。
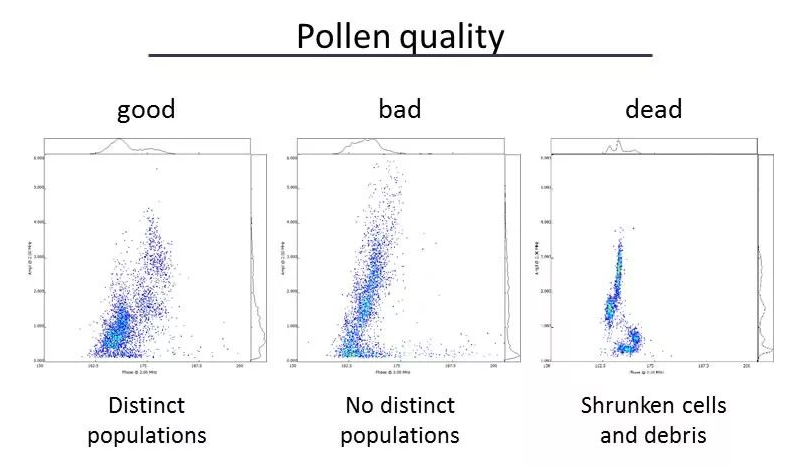
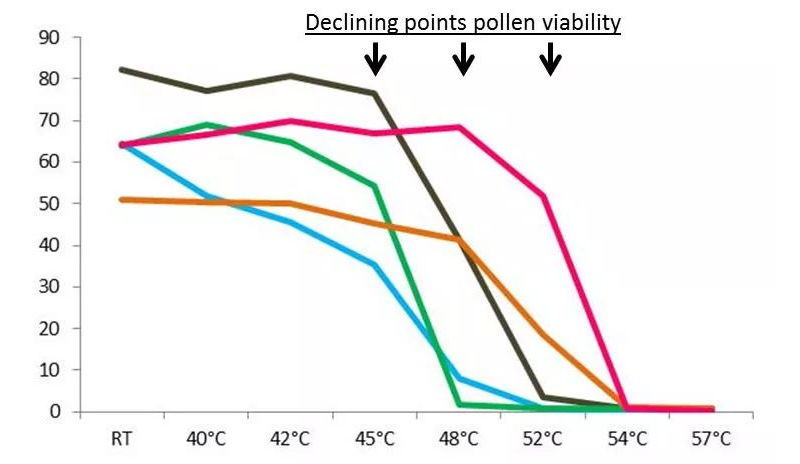
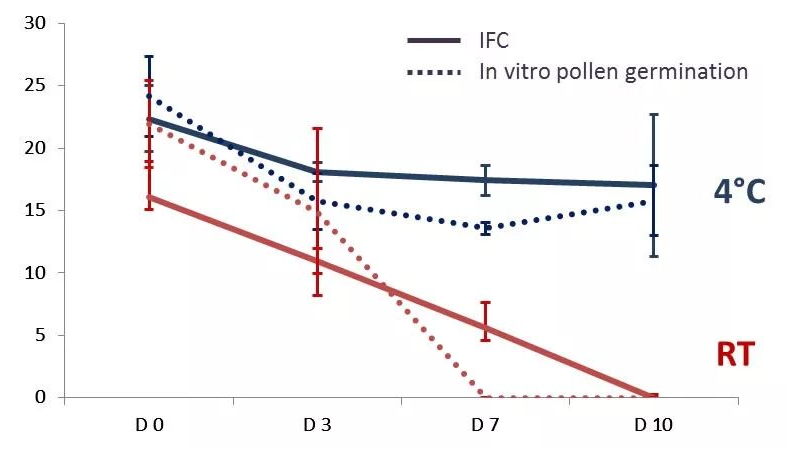
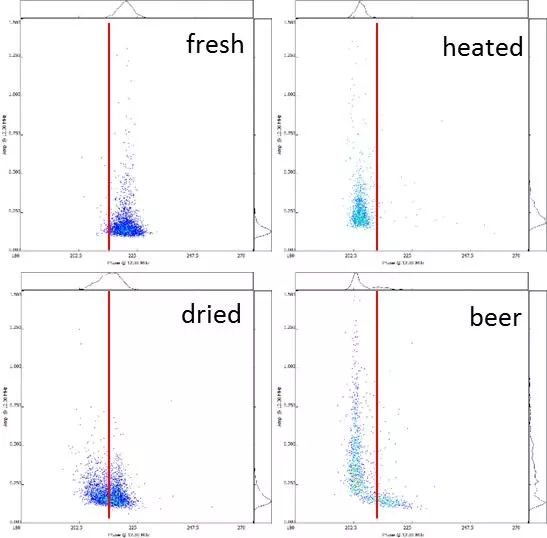
北大荒墾豐種業(yè)-澤泉科技生物技術與表型服務中心是由北大荒墾豐種業(yè)股份有限公司和上海澤泉科技股份有限公司共同建設的開放式高通量植物基因型-表型-育種服務平臺。中心建立了基因克隆和載體平臺����、作物轉化系統(tǒng)、基因型分析平臺�、表型鑒定分析平臺、數據分析和利用平臺等現代化生物技術和信息支持平臺��,是定位于為植物科研和作物育種提供植物基因型-表型-育種數據分析的科研服務平臺�����。為了縮短您的育種進程���,提高您的育種成功率,北大荒墾豐種業(yè)澤泉科技生物技術與表型服務中心將為您提供一體化DH生產服務��。我們提供DH服務技術流程:從實驗室——溫室——田間一體化服務�。父本誘導系誘導母本材料�,孤雌生殖,產生單倍體種子(幼胚)��。20-60份/皿��。置于人工培養(yǎng)室(帶光照層架)或人工培養(yǎng)箱中培養(yǎng)48小時左右���。將幼胚在體視熒光顯微鏡下觀察或者在日光燈下觀察,以自交系所得幼胚為對照����。因為雜合二倍體含有父本基因,所以單倍體有微弱熒光或無色���。將挑選的擬單倍體直接置于含有加倍藥劑(秋水仙素)的MS培養(yǎng)基上�,暗培養(yǎng);后轉入不含加倍藥劑的MS培養(yǎng)基�����,暗培養(yǎng)后光照培養(yǎng)�����,待幼苗2葉一心時移至培養(yǎng)瓶中(MS培養(yǎng)基)。將培養(yǎng)瓶中DH系幼苗在4葉一心時移栽至苗缽,在溫室中煉苗�����。待幼苗5-6葉期移栽至溫室花盆或大田,待散粉時���,及時套袋進行自交授粉��。田間收獲和鑒別����。如果用采用花藥離體培養(yǎng)單倍體的方法,則省去觀察幼胚的步驟�,其余步驟基本相同。花粉作為一種重要的種質資源����,被廣泛利用到科學研究��、新品繁育����、農業(yè)研究�����、種子生產等領域中����。通常,花粉容易受到光照����、溫度、濕度等環(huán)境因素的影響����,因此花粉活力檢測是育種和農業(yè)生產過程中必不可少的檢測指標。篩選高活性的花粉進行授粉可以提高作物結籽率�����、果品品質,提高產量預測的準確性�����,進而減少農業(yè)生產過程中不必要的損失����。傳統(tǒng)上進行花粉活力檢測主要通過染色法和體外萌發(fā)法,然而這兩種方法費時耗力�、通量低、適用性及統(tǒng)計性差���,往往不能滿足育種���、生產過程中的日常需求?���;ǚ刍盍Ψ治鰞x通過檢測流經交流電場的花粉顆粒的電阻抗特性,實時獲取大量花粉顆粒的大小�、活性���、濃度等數據��。該方法已應用于上百種植物花粉活性的檢測���,是一種高效���、可靠且標準化的檢測技術。澤泉科技AgriPheno平臺已引進Ampha? Z40花粉活力分析儀并向廣大育種家和農業(yè)生產者推出花粉活力的檢測分析服務��。DH育種是利用誘導系誘導(或花藥離體培養(yǎng)等手段誘導)產生單倍體植株�����,再通過染色體組加倍(自然加倍或藥劑處理)使植物恢復正常染色體數的育種方法�����。由于自然單性生殖或孤雄生殖單倍體非常罕見�����,因此單倍體的獲得成為單倍體育種的一個難點�����,游離小孢子培養(yǎng)是獲得單倍體的重要手段之一?����;ǚ刍盍Ψ治鰞x(阻抗流式細胞技術��,IFC)可以在DH育種過程中�,幫助選擇小孢子植物供體,評估小孢子胚誘導策略���,優(yōu)化培養(yǎng)條件��,并在小孢子培養(yǎng)早期進行產胚量的準確預測�,可顯著提高游離小孢子培養(yǎng)的成功率�,進而加快DH育種的效率。花粉的形成受到遺傳因素的嚴格控制�����,而當控制花粉發(fā)育的基因發(fā)生突變時將導致花粉質量降低����、花粉數量減少或是完全沒有花粉。雜交育種過程中����,花粉敗育的雄性不育系是理想的母本,而任意環(huán)境下具備大量高活性花粉的雄性可育系則是理想的父本�。優(yōu)化花粉發(fā)育條件,篩選優(yōu)質�����、高抗品種花粉活性通常會受到光���、熱溫度�、農藥等環(huán)境因素的影響�����,可以通過不同條件下花粉的活性來確定花粉生長的理想條件�,或篩選優(yōu)質、高抗品系����。下圖為五種不同植物花粉對溫度變化的響應,如圖所示��,某些花粉是可以暴露在50℃的高溫下的(粉色)�����,而其他花粉則在45℃就逐漸失活。這表明每一種花粉都有其理想的生長溫度���,獲得高活性花粉不能超過其理想生長溫度����。育種和生產過程中��,通常會遇到花期不育的問題����,這就需要提前采集花粉,保存?zhèn)溆?�。但自然條件下�����,絕大多數植物花粉的壽命都較短���,而且容易受溫度���、光照等因素的影響�,因此��,何時收獲花粉��,收獲后如何保存并維持花粉的活力則至關重要��。未開放的花苞(左)和剛剛開放的花朵(中)���,花粉具備活性,當花蕊完全伸展后(右)�,花粉則不再具備活性。真菌孢子細胞與花粉粒具有高度相似性�����,因此也可以進行類似的活性檢測����,目前已檢測過的細胞有細菌、酵母�����、藻類、動物�����、人體等單細胞�����。下圖為不同來源的酵母活性的對比����,如圖所示,鮮酵母活性較高���;�����,而干燥酵母���,即使于室溫下培育1小時,它的活性仍然比新鮮酵母低��;取自啤酒的酵母細胞活性較差。如您需要了解更多信息���,請點擊或掃描下方二維碼填寫登記表���,我們會為您提供專業(yè)的服務,真誠期待與您的合作�!